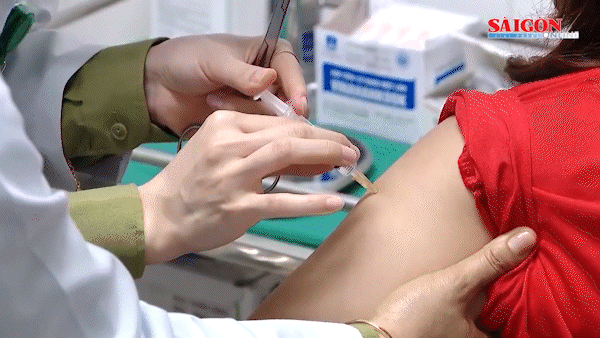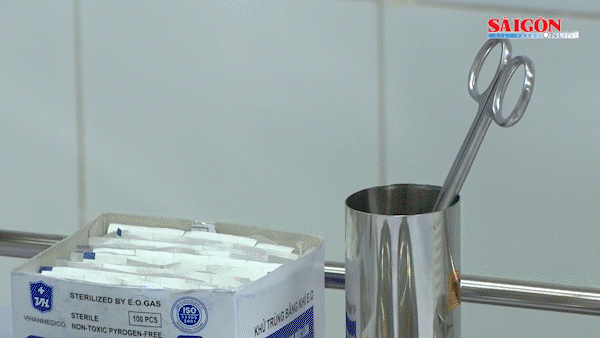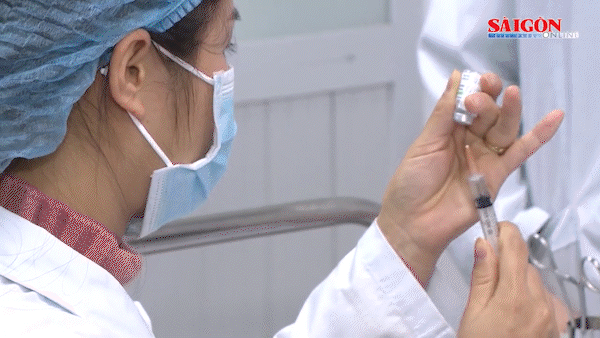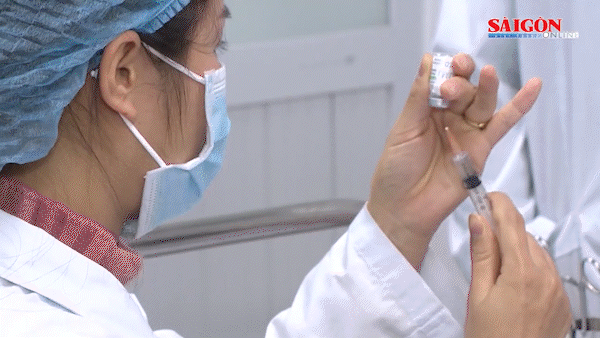
(SGGP).- Ngay sau khi nhận được công văn của Văn phòng đại diện Công ty GlaxoSmithKline Pte. Ltd (GSK) Việt Nam thông báo về việc phát hiện sự có mặt ADN của PCV-1 (porcine circovirus 1) trong vaccine Rotarix và vaccine có chứa virus bại liệt bất hoạt (IPV) do GSK sản xuất, chiều 24-3, Cục Quản lý dược Việt Nam đã có văn bản khẩn gửi GSK yêu cầu công ty này thông báo khẩn về cục các tài liệu chứng minh tính an toàn của vaccine Rotarix phòng ngừa Rotavirus và vaccine có chứa virus bại liệt bất hoạt (IPV) khi có sự hiện diện ADN của PCV-1. Đồng thời cung cấp đến Cục Quản lý dược các tài liệu về việc xử lý của cơ quan quản lý các nước như: FDA - Mỹ, Tổ chức Y tế châu Âu, nước sở tại (Bỉ) về vấn đề này.
Liên quan đến vấn đề này, cùng ngày, Cục Quản lý dược đã gửi văn bản khẩn đến Cục Y tế dự phòng và môi trường, Viện Vệ sinh dịch tễ Trung ương, Viện Kiểm định quốc gia vaccine và sinh phẩm y tế để xin ý kiến xử lý đối với vaccine Rotarix và vaccine có chứa virus bại liệt bất hoạt (IPV) của Công ty GSK.
Trước đó, Cơ quan điều phối dược phẩm châu Âu cũng đã yêu cầu GSK giải trình về việc sau khi phát hiện virus gây cúm A/H1N1 trong vaccine Rotarix phòng bệnh tả cho trẻ em do hãng này sản xuất.
Q.LẬP