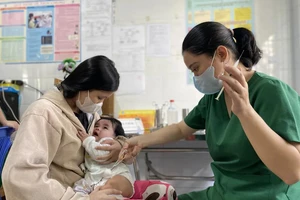
(SGGP). - Chiều 4-5, Cục Quản lý dược, Bộ Y tế đã có thông báo khẩn gửi Sở Y tế, Trung tâm Y tế dự phòng và Ban Quản lý dự án tiêm chủng mở rộng các tỉnh thành phố trong cả nước về việc tạm ngừng sử dụng vaccine “5 trong 1” Quinvaxem inj trong dự án tiêm chủng mở rộng.
Đây là vaccine “5 trong 1” phối hợp 5 thành phần DTwP-HepB-Hib dạng lỏng, có tác dụng ngừa bệnh bạch hầu, ho gà, uốn ván, viêm gan B và Hib (viêm phổi - viêm màng não), số đăng ký: QLVX-0604-12 do Công ty Berna Biotech Korea Corporation sản xuất.
Cục Quản lý dược cũng yêu cầu văn phòng đại diện của công ty này tại Việt Nam phải gửi thông báo tạm dừng sử dụng tới những nơi phân phối, sử dụng vaccine và yêu cầu các đơn vị bảo quản theo đúng điều kiện quy định ghi trên nhãn của vaccine. Đồng thời, báo cáo về tình hình nhập khẩu, quá trình phân phối và sử dụng vaccine “5 trong 1” Quinvaxem về Cục Quản lý dược và Cục Y tế dự phòng trước ngày 15-5. Sở Y tế, Trung tâm Y tế dự phòng và Ban Quản lý dự án tiêm chủng mở rộng các tỉnh, thành phố thông báo cho các cơ sở kinh doanh, sử dụng vaccine thực hiện thông báo này.
Theo ông Nguyễn Việt Hùng, Phó Cục trưởng Cục Quản lý dược cho biết, việc quyết định tạm ngừng sử dụng loại vaccine phối hợp “5 trong 1” trên là do thời gian gần đây đã có một loạt trường hợp tai biến, thậm chí là tử vong sau khi tiêm chủng loại vaccine này. Tuy nhiên cho tới nay, các cơ quan chức năng vẫn chưa tìm ra nguyên nhân do vaccine hay do cơ địa của trẻ khi tiêm. Do đó để đảm bảo an toàn cho trẻ em và để tránh xảy ra những trường hợp tử vong đáng tiếc, cục quyết định yêu cầu tạm dừng sử dụng vaccine Quinvaxem inj.
QUỐC KHÁNH